Traitement d’élimination des ions dissous dans l’eau au travers de résines échangeuses d’ions réactivées au moyen de régénérants.
Le principe de l’échange d’ions consiste en l’échange d’ions entre un solide et un liquide, au cours duquel il n’y a pas de modification notable de la structure du solide.
L’échange d’ions étant une réaction réversible, le matériau d’échange peut être régénéré pour d’autres processus.
Principaux types:
Technologies
ÉCHANGE D'IONS
- Déminéralisation
- Cation – Anion
- Lit mixte
- Dénitrification
- Décarbonatation
- Décalcification
- Autres
APPLICATIONS
- En tant que post-traitement d’autres procédés, par exemple, l’osmose inverse
- Dans les procédés industriels, associés à divers secteurs:
- Dans l’industrie agroalimentaire
- Dans l’industrie chimique et pharmaceutique
- Dans les secteurs de l’énergie, de l’électronique et du nucléaire
- Pour le traitement de surfaces
- Pour l’approvisionnement de chaudières en eau
- Pour la potabilisation de l’eau (élimination du perchlorate et de l’uranium, entre autres)

FONCTIONNEMENT
Les échangeurs d’ions sont des substances insolubles se présentant sous forme de granulés, comme de petites billes, appelées résines, et qui sont capables d’absorber des ions d’une solution et de donner en retour une quantité équivalente d’un autre ion sans modification apparente de leur aspect physique ni de leur solubilité.
Cet échange ne fonctionne qu’entre des ions de charges électriques égales (cations pour les cations et anions pour les anions).
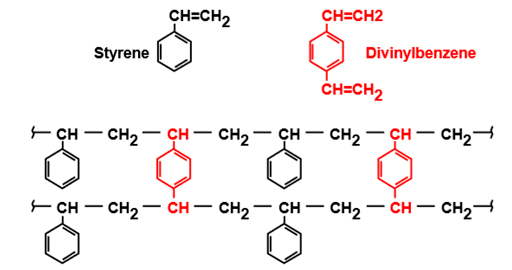
La résine la plus courante est obtenue par copolymérisation du styrène et du divinylbenzène (DVB), qui se solidifient sous forme de sphères dans lesquelles on insère le groupe d’échange actif.
Ces résines ont une surface spécifique et une uniformité différentes selon le type d’application et le groupe de radicaux actif.
| CATIONIQUES
(C) |
FORTS (CF)
Groupes sulfoniques (R-SO3) |
Régénérées avec du NaCl: Elles échangent des cations divalents et trivalents contre des ions sodium.
Régénérées avec un acide fort: Elles échangent tous les types de cations contre des ions H+ |
| FAIBLES (CD)
Groupes carboxyliques (R-COOH) |
Régénérées avec un acide fort: Elles échangent des cations acides fables et hydroxydes faibles contre des ions H+ | |
| ANIONIQUES
(A) |
FORTS (AF)
Groupes ammonium quaternaire |
Elles échangent des anions acides forts et faibles (SiO2, CO2, acides organiques) contre des groupes OH- |
| FAIBLEMENT BASIQUES (AD)
Groupes ammonium tertiaire |
Elles échangent des anions acides forts (Cl-, SO4=, NO3) contre des groupes OH- | |
| MODÉRÉMENT BASIQUES | Mixte entre les deux précédentes | |
| SPÉCIAUX | Macroporeuses | Elles peuvent être CF, CD, AF, AD et ont une meilleure résistance mécanique, thermique et aux oxydants |
| Sélectrices de métaux | CF régénérées à l’aide d’acide | |
| Absorbantes ou adsorbantes | AF microporeuses retenant la matière organique et les colloïdes. Régénérées avec du NaCl |
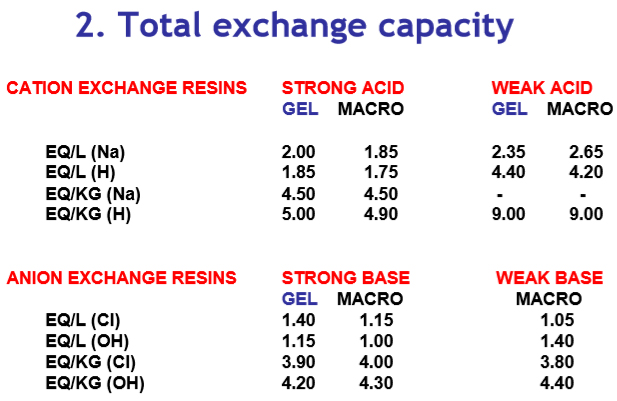
La capacité d’échange des résines sera différente pour chaque type. Il s’agit d’une mesure du nombre total de sites actifs disponibles pour l’échange (équiv./L ou équiv./kg). De plus, un changement de volume se produit.
Les valeurs typiques pour les résines sous différentes formes ioniques sont:
Une fois la capacité d’échange atteinte, on peut dire que la résine est épuisée. Lorsque cela se produit, on procède à sa régénération. Il s’agit d’un ensemble d’opérations permettant le déplacement des ions retenus jusqu’à ce que la résine retrouve son état de charge initial.
La première opération du processus est le lavage à contre-courant : de l’eau est envoyée vers le haut, ce qui provoque la décompaction du lit et l’élimination des éventuelles particules qui auraient pu être retenues. Cette opération est réalisée à une vitesse critique fixée par le fabricant de la résine.
Ensuite, dans le sens du lavage, une solution régénérante est introduite, contenant:
- HCL ou HSO4 pour l’échange de cations
- NaOH (soude caustique) pour l’échange d’anions
Cette opération est réalisée à une concentration contrôlée, spécifique dans chaque cas.
Le lit est ensuite lavé, ce lavage se compose de deux étapes : un lavage lent dont l’objectif est de s’assurer que la solution régénérante atteint la totalité du lit, et un lavage rapide afin d’éliminer toute trace de solution régénérante restante et de laisser la résine dans un état propre à commencer un nouveau cycle de travail.
Le processus se produisant durant la régénération est le processus inverse à celui de l’épuisement.
- Pour les résines cationiques: Na-R + HCl -> H-R + NaCl
- Pour les résines anioniques: Cl-R + NaOH -> R-OH + NaCl
Les eaux naturelles contiennent des ions calcium et magnésium formant des sels peu solubles.
Ces cations, parmi d’autres cations moins courants comme le strontium ou le baryum, sont appelés ions de dureté. Lorsque l’eau s’évapore, ils peuvent précipiter et former des solides.
L’eau dure provoque l’entartrage et peut entraîner une turbidité, il est donc nécessaire d’éliminer ces composants dans la mesure du possible afin d’obtenir une eau moins dure.
Dans ce but, on utilise des résines échangeuses de cations fortement acides dans lesquelles l’ion échangeable est le sodium Na, appelées généralement résines cationiques à cycle sodium.
La réaction générale d’échange dans le processus d’adoucissement qui a lieu peut s’exprimer comme suit:
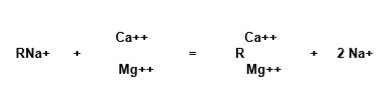
La résine à cycle sodium (RNa) entre en contact avec les ions calcium et magnésium (Ca2+, Mg2+) et les retient, cédant des cations sodium à l’eau.
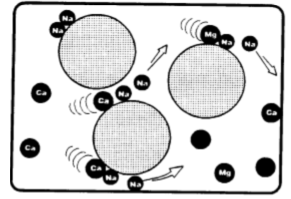
Les cations sodium cédés par la résine se lient aux anions auxquels le calcium et le magnésium étaient liés, formant ainsi le même sel sodique. Dans le cas des bicarbonates de calcium et de magnésium, on a:
Lors de l’adoucissement ou de la décalcification, la salinité de l’eau traitée est la même que celle de l’eau à traiter, à la différence que les sels qui contenaient les ions provoquant la dureté sont transformés en sels de sodium, très solubles et sans propriété entartrante.
Pour le processus de régénération de la résine, on utilisera une solution saline (chlorure de sodium):
- Ca-R + 2NaCl -> CaCl2 + Na2 R